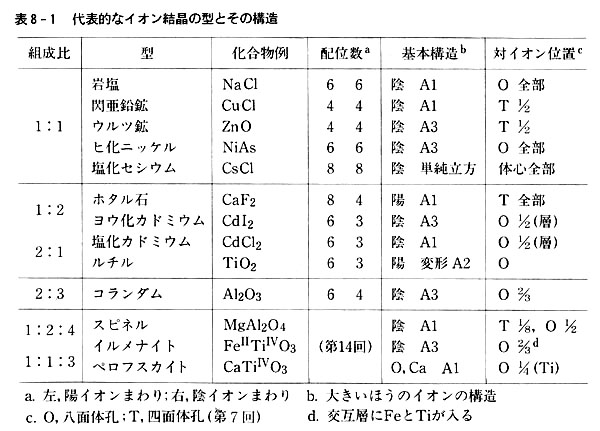
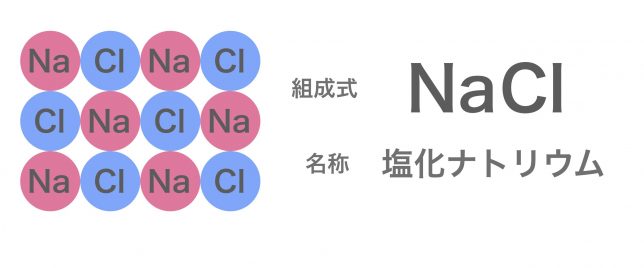
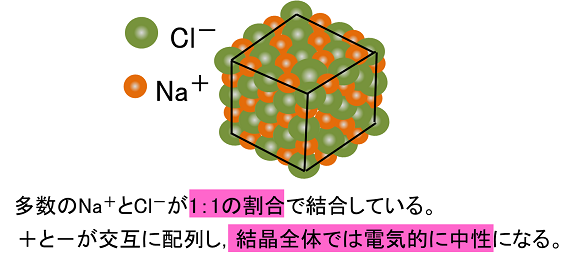
結晶の構造は,陽イオンや陰イオンの大きさ,イオンの価数などで決まります。 組成式 塩化ナトリウムの結晶の中には,ナトリウムイオンNa+と塩化物イオンCl-が同じ数だけ含まれています。 例えば,1 gの塩化ナトリウムNaClの結晶があると,その中には約1022個のNa+とCl-がそれぞれ含まれています。 しかし,NaClとは書き<その他の組成式> 炭酸水素ナトリウム NaHCO 3 硫酸水素ナトリウム NaHSO 4 亜硫酸水素ナトリウム NaHSO 3 酢酸ナトリウム CH 3 COONa 二酸化ケイ素 SiO 2 · イオン結合による結晶です。多数の陽イオンと陰イオンが規則正しく配列して固体に なっています。化学式は組成式で表します。 イオン結晶の見分け方 金属元素と非金属元素 が含まれた物質はイオン結晶です。例えば、NaCl,BaSO 4 など。 例外として、 アンモニウムイオン NH 4 を
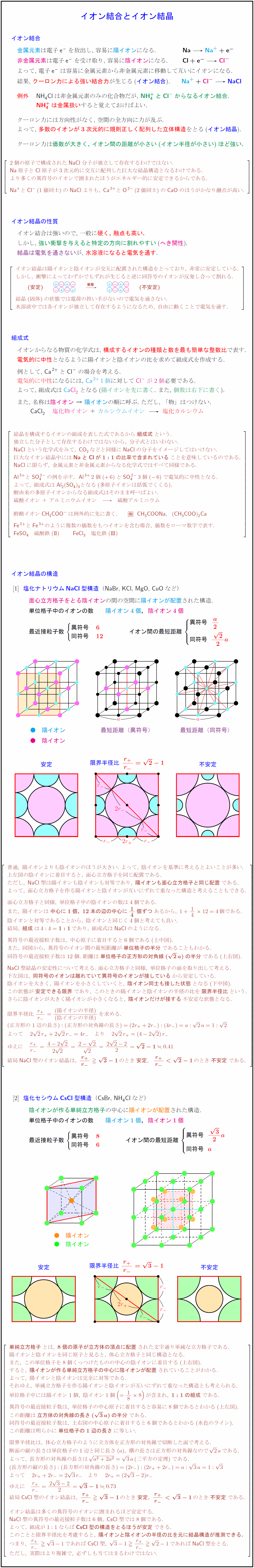
高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月
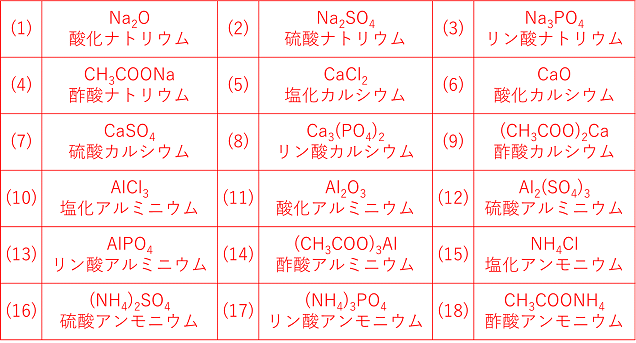
組成式 イオン 結晶 一覧
組成式 イオン 結晶 一覧-イオン の 組成 式 一覧 陽イオン\陰イオン Cl – 塩化物イオン OH – 水酸化物イオン O 2酸化物イオン SO 4 2硫酸イオン Na ナトリウムイオン NaCl イオン の 組成 式 一覧 HomeContactAbout イオン の 組成 式 一覧 陽イオン\陰イオン Cl – 塩化物イオン OH – 水酸化物イオン O 2酸化物イオン SO 4 2硫酸イオン Na ナトリウムイオン NaCl 化学式の種類 / 化学 by 藤山不二雄このように層状珪酸塩は結晶構造により族に分類 され,さ らに化学組成により細かく分類されてい ます 鉱物中の原子配列はx線 回折法で調べる事が出 来ます1910年 代から始まったこの実験法で比較 的大きな結晶を作る鉱物の原子配列は次々と解明




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ
· クエン酸の化学式・構造式や性質を詳しく解説🍋 クエン酸は酸味を持つ物質で、レモンなどの柑橘類に多く含まれるほか、食品添加物としても多用されます。 安全性が高く、水垢などを落とす洗剤としても普及しました。 この記事では、 クエン酸の · 化学基礎で最初の方に習う基礎的な内容の「組成式」と「分子式」ですが、意外とその違いが見分けづらいです。 例えば、CO2は分子式でSiO2は組成式です。 もちろん、わかる人には当たり前なんですが、わからない人にとってはなかなか厳しい内容です。 また、組成式は金属結晶やイオン結晶を表すためのものだと思っています。 そのような間違った認識をして · 陽イオンと陰イオンが、規則正しく並んでいる結晶。 ※イオン結晶の特徴 ①一般に融点が高い 塩化ナトリウムの融点は約800℃ ②硬いがもろい 規則的に配列しているため硬いが、力が加わり配列がずれると「」と「」に反発が起きて特定の面で割れる(へき開) ③個体では電気を通さないが水溶液や液体は電気を通す 熱して液体にしたり、水溶液にすると
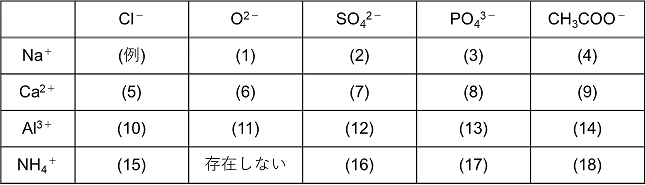
· (4)NH 4 とCl - がイオン結合することで形成されたイオン結晶です。 ただし、NH 4 には、共有結合と配位結合が含まれています。 (5)Na とOH - からできたイオン結晶ですが、OH - には共有結合により構成されています。 · 組成式の問題で、塩化ナトリウムなどの無機物を扱うときには、化学式を与えられず、組成式を物質の名称から答えなければならない場合もあります。 よく用いられる陽イオンと陰イオンの一覧表を作って覚え、組み合わせ方を理解しておけば簡単に問題を解けるようになるでしょう。 よく登場するイオンとしては、次のようなものがあります。 陽イオンLi、Naゼオライトとは 含水アルミノケイ酸塩(結晶水をもったアルミニウムとケイ素の酸化物)の総称で、細孔が規則的に空いている多孔質材料です。 一般的な組成と結晶モデルは以下のようになります。 ゼオライトは食品用の製造用材として、食品添加物法
単位格子に含まれるイオンの数 ・ナトリウムイオン 1/4 × 12 1=4 ・ 塩化物イオン 1/8 × 8 1/2 × 6 =4 塩化ナトリウム型の例:LiF , NaBr , KI , MgO , CaS より入試に近い問題としては、結晶の単位格子から化合物の組成式を問う問題も出て来ます。イオン 組成 式 一覧 高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube 3 1 イオン結合とイオン結晶 おのれー Note For more information and source, see on this link https · 組成式と分子式の見分け方はどうすればいいのでしょうか? 解説に組成式→イオン結合、金属、共有結合の結晶分子式→構成する原子が共有結合により結合している物質とあり、両方とも共有結合が含まれるので見分け方がわかりません。 まずは金属元素か非金属元素の区別ができるように




化学式とは コトバンク




化学基礎テ対 物質の構成 化学結合 高校生 化学のノート Clear 化学結合 化学 高校 勉強
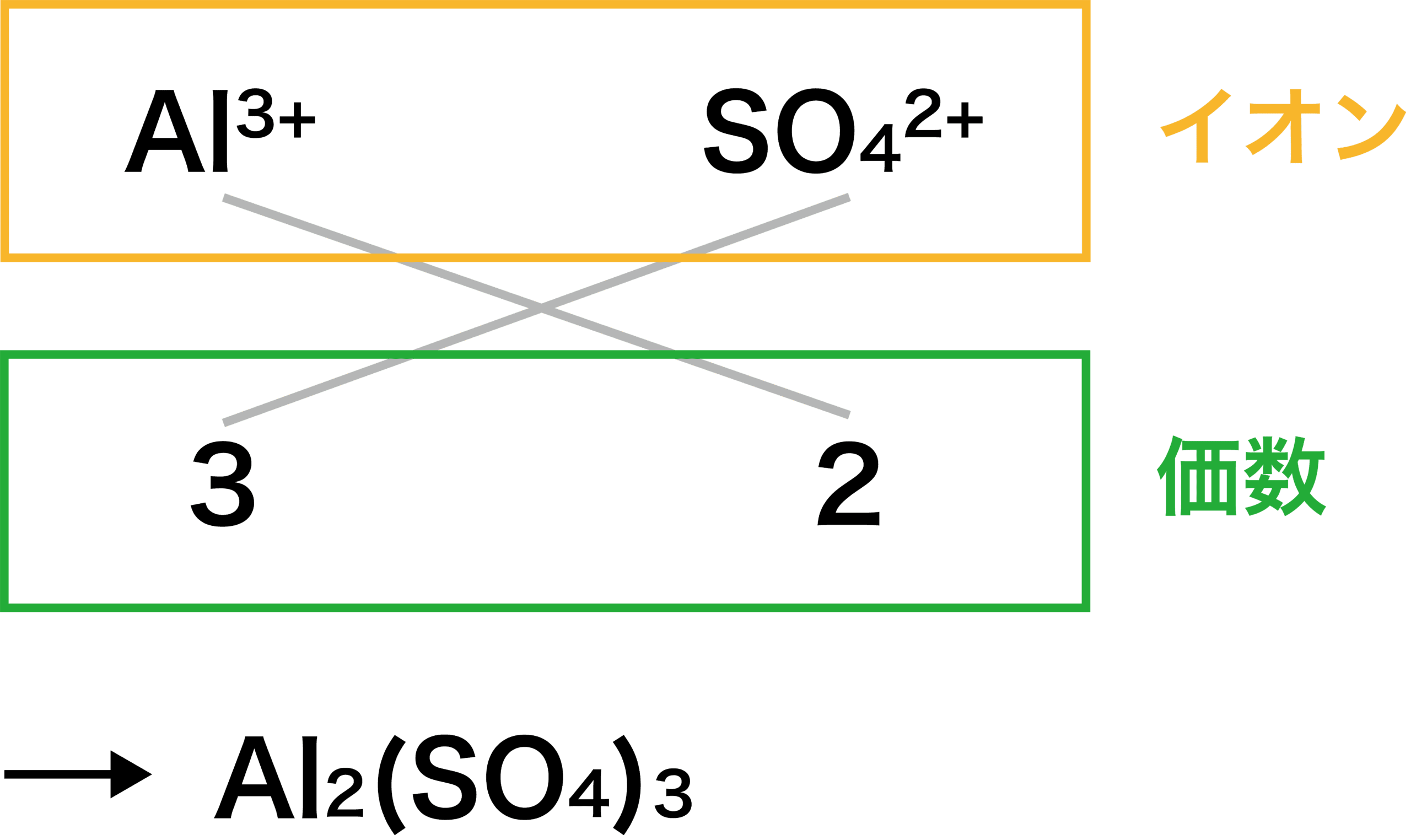
化学 組成 式 一覧 高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube 3 1 イオン結合とイオン結晶 おのれー Note For more information and source, see on this link httpsまずは、2つのイオンを陽イオン→陰イオンの順に並べます。 陽イオンはNa ,陰イオンはClですね。 Na 、Clと書いておきます。陽イオンの価数×陽イオンの数=陰イオンの価数×陰イオンの数 「Al3」と「SO4 2 」をくっつけてみましょう。 上記の公式を使うと 3×陽イオンの数=2×陰イオンの数 ですので 陽イオンの数=2、陰イオンの数=3となり「Al2(SO4)3」ができあがります。 ・ 高校化学 共有結合における結合エネルギーの特徴 ・ 共有結合とイオン結合の違い~共有結合の例~ 組成式
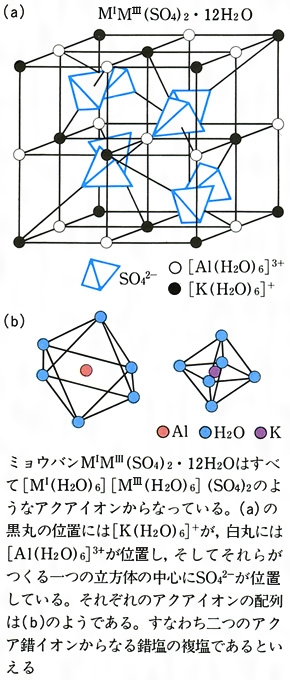



ミョウバンとは コトバンク



危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ
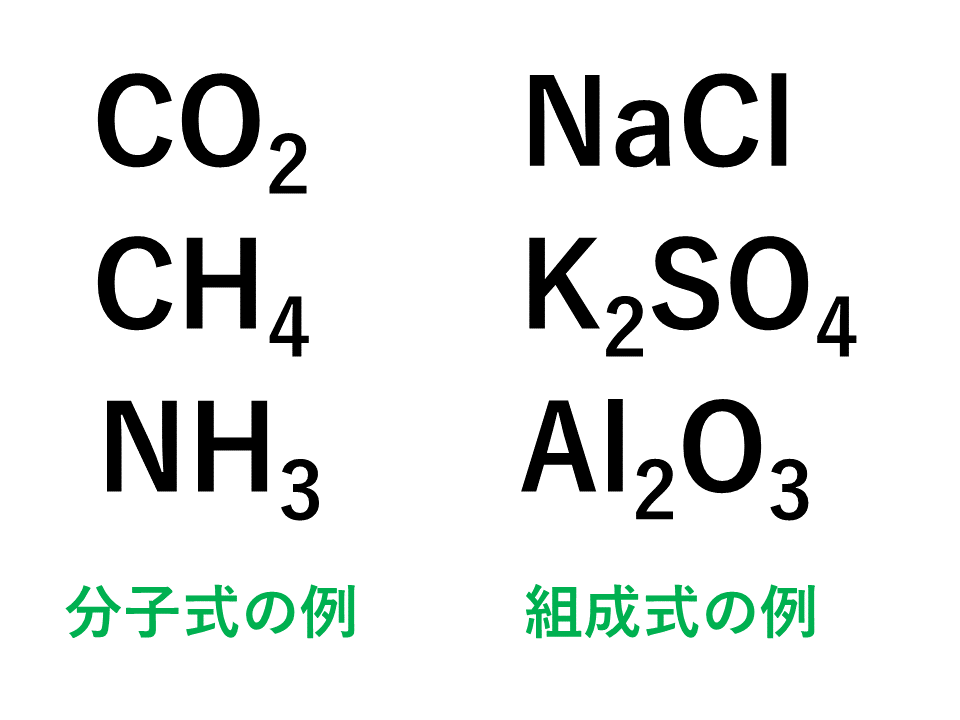
1つの分子を構成する元素とその数をただ単に羅列したものであらわされます。 酢酸:C₂H₄O₂やグルコース:C₆H₁₂O₆など。 最も、酢酸やグルコース他は組成式でも分子式でも構造式でもなんだってあらわされます。 ここで勘違いしてほしくないのは イオン式や組成式、分子式は単なる表し方にすぎない ということ。 この分野で苦手意識を持っている学生は · なので、イオン結晶を表す化学式は、陽イオンと陰イオンがどのくらいの割合で結びついているか、その割合を最も簡単な整数比で表した式、組成式で表します。 組成式を書くときには、 ① 構成する陽イオンを左に、陰イオンを右に、電荷を取った(右上の数字と符号を除いた状態で)書きま・組成式 物質を構成する原子の種類と個数の割合を表す fe, cu, nacl, cuo ・示性式 物質の特徴的な性質を表す c 2h 5oh, ch 3och 3, ch 3cooh ・電子式 物質を構成する原子の電子配置を表す 配列した結晶をつくっており,これをイオン結晶という。



組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




高校化学 ファンデルワールス力 充填率 組成式と分子式を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ
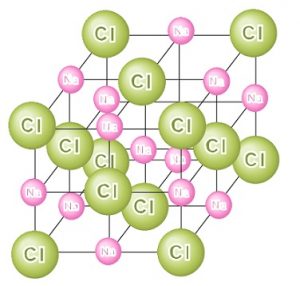
1からすべてわかりません。どなたかよろしくお願いいたします h6 入試攻略 必須問題) こ次の2 右図は塩化ナトリウムの結晶の単位格子を示した ものである。この図をもとに次の問いに答えよ。 ます。 問入 ナトリウムイオン, 塩化物イオンのそれぞれ の配位数を求めよ。 · 組成式とは? これは、NaClのイオン結晶である岩塩です。 これは、NaとClがずっとイオン結合を連ねて、このような目に見える形になっているのです。 このように、無限にイオン結合が続いているわけですよ。 じゃあ、 分子式 みたいにその塊の原子の数を全部書き出したとします。 すると、この岩塩には、Na とCl – が日本の人口以上に詰まっているわけですよ · イオン結晶組成式 分子結晶分子式 金属結晶組成式 共有結合結晶組成 4 組成式がわかりません。 次の問題の化学式のうち、 組成式で表されているものをすべて選べ アNH3 イ 5 化学組成式について質問です。 Wikipediaでは、オーケン石の組成式が Ca10Si18O46と



イオン結晶 化学基礎 高校化学net参考書



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム
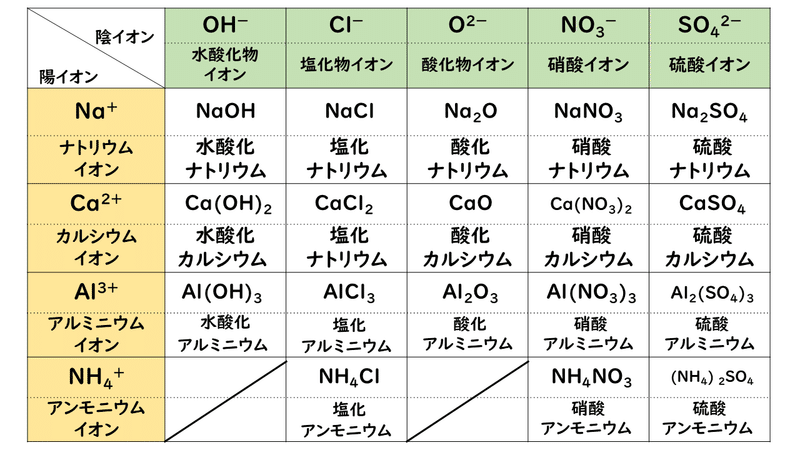
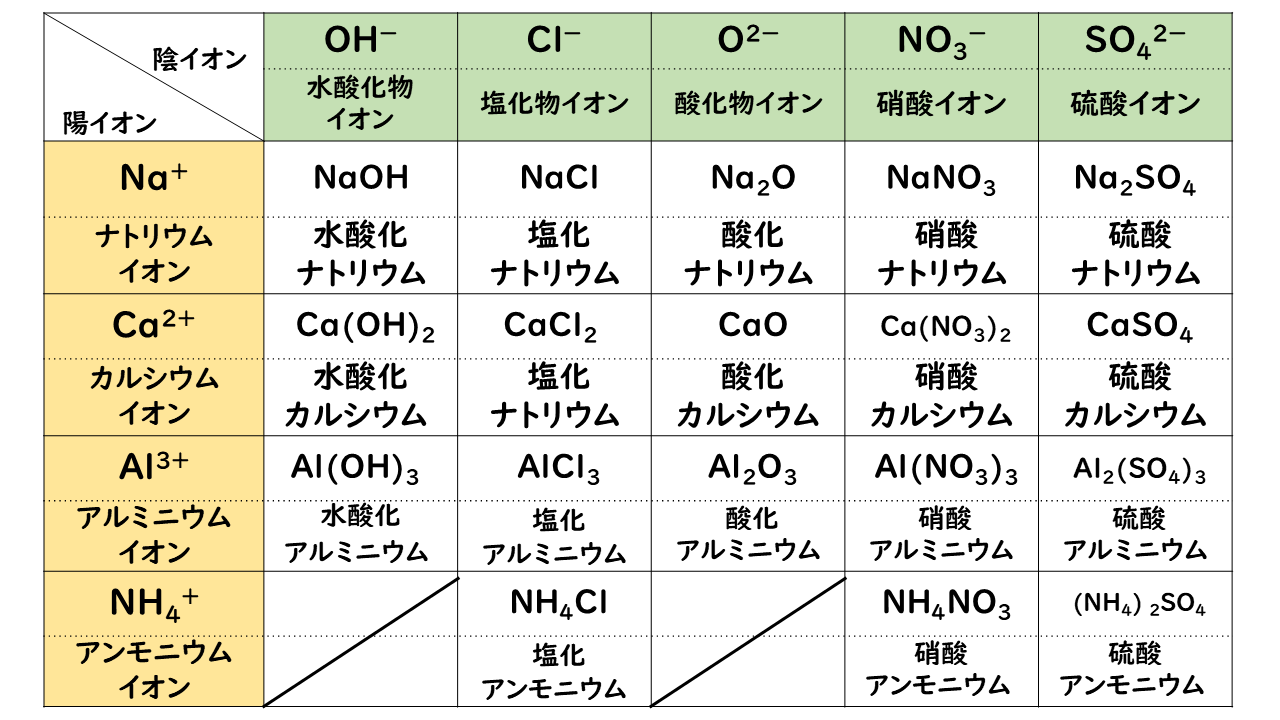
· イオン式の一覧を中学生向けに作成 しました。 さっそくイオン式の一覧を下に載せますが、 その下にはさらに、 化学式やイオン式の確認と解説 や イオン式の練習問題 も作ったので、ぜひ勉強に活用してください!このように有機物では 化学式、分子式、組成式が異なります。 一方、無機物だとどうでしょう。 水の場合は、 化学式h 2 o 分子式h 2 o 組成式h 2 o 全部同じになって 身の回りにある物質は細かく見ればすべて化学式で表せます。イオン式もその1つです。組成式 結晶系 結晶構造 色 電池構成要素 ゲルマン酸リチウム亜鉛(リシコン) Lithium zinc germanate (LISICON) Li 14 Zn(GeO 4) 4 直方晶系 リシコン型構造 無色 電解質(リチウムイオン導電体) チタン酸リチウムランタン Lithium lanthanum titanate Li 035 La 055 TiO 3



化学 組成式の作り方教えてください 塩化アンモニウムを組成式で表すとnh Yahoo 知恵袋




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ
・イオン結合でできている物質は「組成式」によって表現(結晶ができてしまい、分子と違って切れ目がないため) ・構成している元素の種類と、数の比によって表現 ・正負の電荷を打ち消すようにできている このレッスンの動画一覧 1.組成式 · イオン結晶 イオン結晶の概要 ナビゲーションに移動検索に移動目次1 解説2 構造3 例31 1価の陽イオンと1価の陰イオンからなるイオン結晶32 1価の陽イオンと2価の陰イオンからなるイオン結晶33 2価の陽イオンと2価の陰&o 1 2 2 & &o &o 1 1 2 & 2 2 分子と共有結合 共有結合 非金属元素どうしの結合。 原子間で不足分の電子を出し合って共有することによってできる結合。



第8章 イオン結晶




高校理論化学 イオン結合とイオン結晶 Nacl型 Cscl型構造 イオン限界半径比 受験の月




硝酸アンモニウムはイオン結晶なのは何故ですか 硝酸アンモニウムが 化学 教えて Goo



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ




14 号 非水電解質リチウムイオン二次電池用正極材料およびその正極材料を用いた非水電解質リチウムイオン二次電池 Astamuse




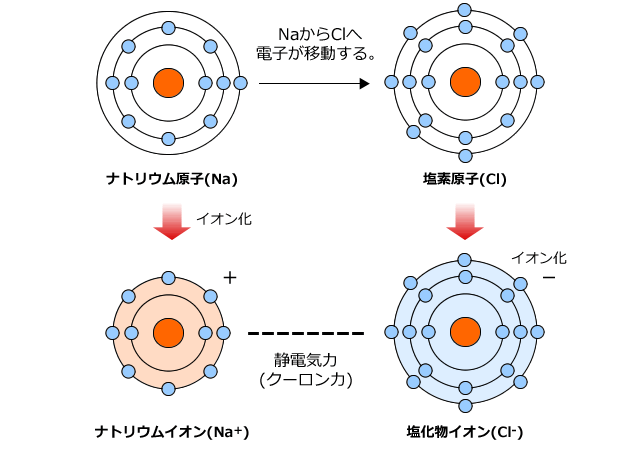
イオン結合とイオンからなる物質




イオン結晶の物質はすぐに書ける 化学がちょっとだけ好きな社労士




イオン結晶 共有結合の結晶 分子結晶まとめ 理系ラボ



化学講座 第10回 イオン結合とイオン性物質 金属結合と金属結晶 私立 国公立大学医学部に入ろう ドットコム



5分でわかる イオン結合とは 共有結合との違いと組成式 分子式を図で徹底解説 サイエンスストック 高校化学をアニメーションで理解する
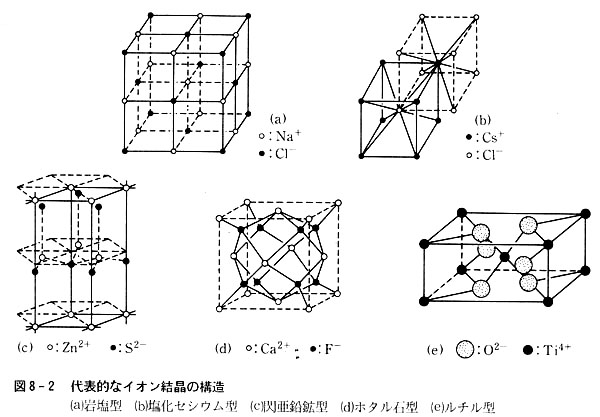



第8章 イオン結晶
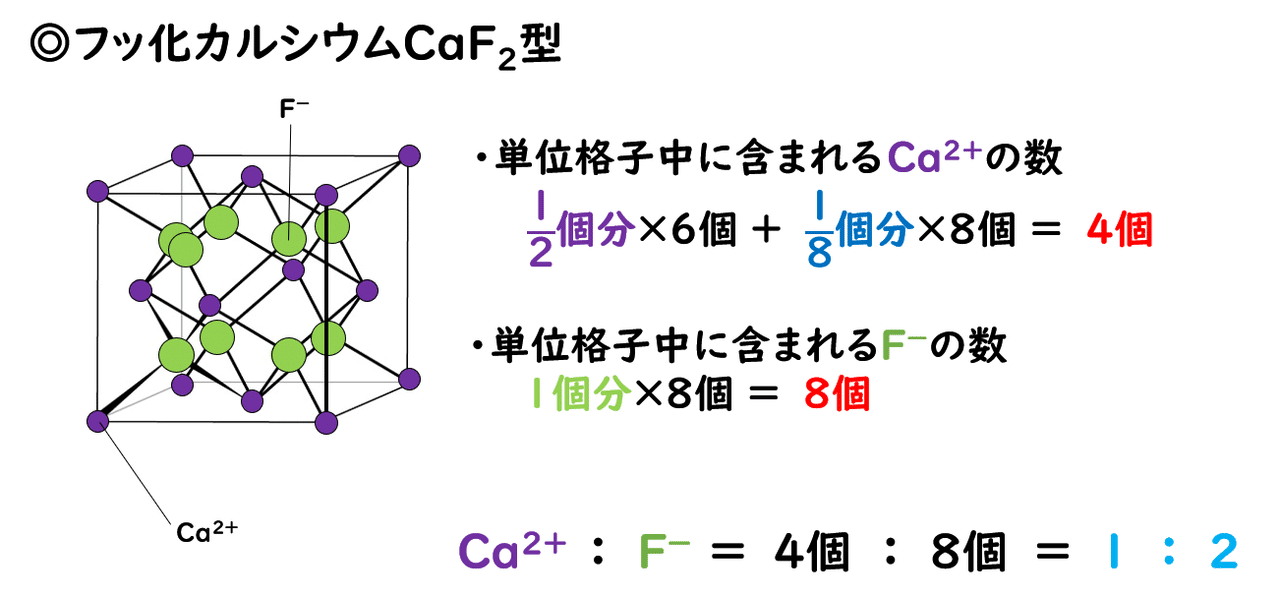



1 3 イオン結晶の構造 おのれー Note



イオン結合の組み合わせ理科の講義ノート Lecture Notebook




単位格子で示されたイオンの原子量 理論化学 計算 センター化学対策過去問題集



酢酸アンモニウムの組成式について 酢酸アンモニウムの組成式はc Yahoo 知恵袋



画像はあるイオン結晶の単位格子である 黒丸 A は陽イオン 白丸 B Yahoo 知恵袋




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



トップ 100 組成式 一覧 すべての鉱山クラフトのアイデア




について質問です Clear




高校理論化学 その他のイオン結晶 Caf Sub 2 Sub 型 Zns型構造 受験の月




イオン結合でできるイオン結晶を表す組成式って何




組成 式 一覧




なぜaの単位格子の角1つは4分の1なのにbの単位格子の角1つは8分の1なのですか Clear



イオン結合でできるイオン結晶を表す組成式って何



3 1 イオン結合とイオン結晶 おのれー Note
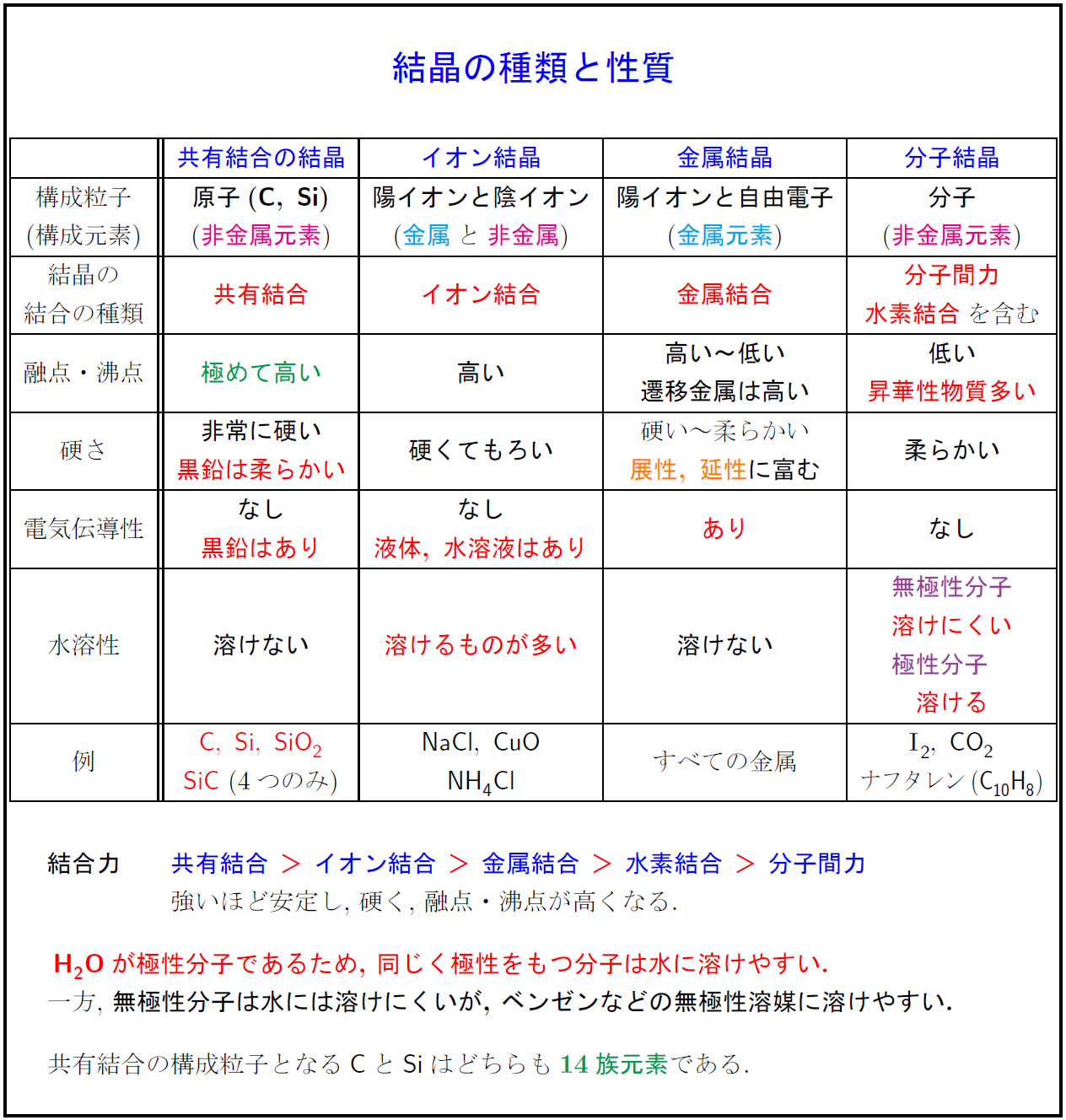



高校理論化学 結晶4種類 共有結合の結晶 イオン結晶 金属結晶 分子結晶 と性質まとめ 受験の月
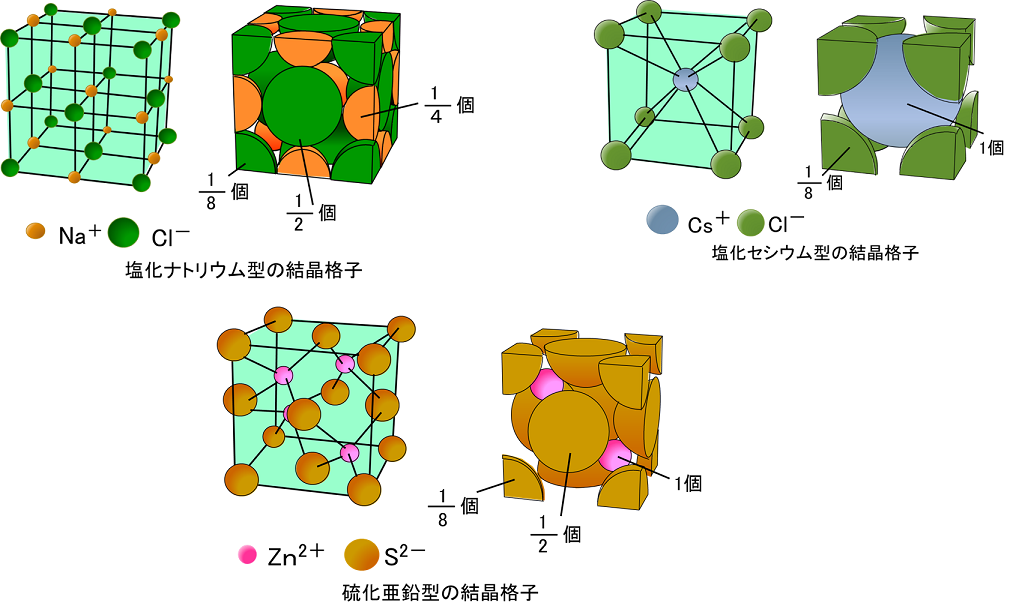



イオン結合とイオンからなる物質




トップ 100 硝酸 カルシウム 組成 式 Minecraftの最高のアイデア



高一化学 炭酸イオンとマグネシウムイオンの組成式はこれで合ってます Yahoo 知恵袋



イオン結合とイオンからなる物質




Div Lihat Cara Penyelesaian Di Qanda




イオン結晶 共有結合の結晶 分子結晶まとめ 理系ラボ
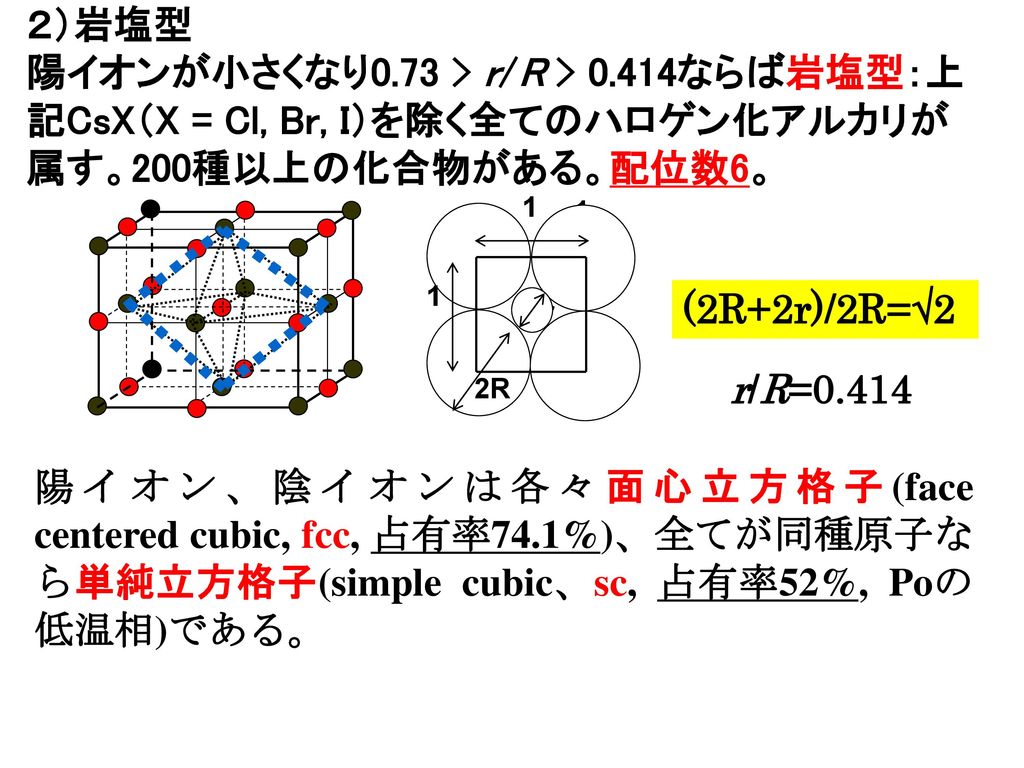



3章 イオン結合とイオン結晶 最終回 3 2 イオン結晶の構造 Ppt Download




金属結合とは 例 特徴 金属結晶 立方格子 理系ラボ



イオン結合とは何か 組成式や名称の書き方は 高校化学をスキマ時間でわかりやすく



組成式 Japaneseclass Jp




これを見ても 組成式の作り方が分かりません Clear




化学基礎 イオン結合の組成式 その4 名称 Youtube




化学基礎 イオン結合とイオン結晶 高校生 化学のノート Clear



次のイオンが結合してできている イオン結晶の組成式と名称を答え Yahoo 知恵袋




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube




組成式とは 入試で必要な知識と勘違いするポイントをまとめてみた 化学受験テクニック塾



イオン結合とイオンからなる物質




高校化学基礎 組成式の書き方 映像授業のtry It トライイット




組成式 Japaneseclass Jp



イオン結合とイオンからなる物質 化学コラム



イオン結合とイオンからなる物質




化学基礎 イオン結晶の組成式 Youtube



第8章 イオン結晶




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材
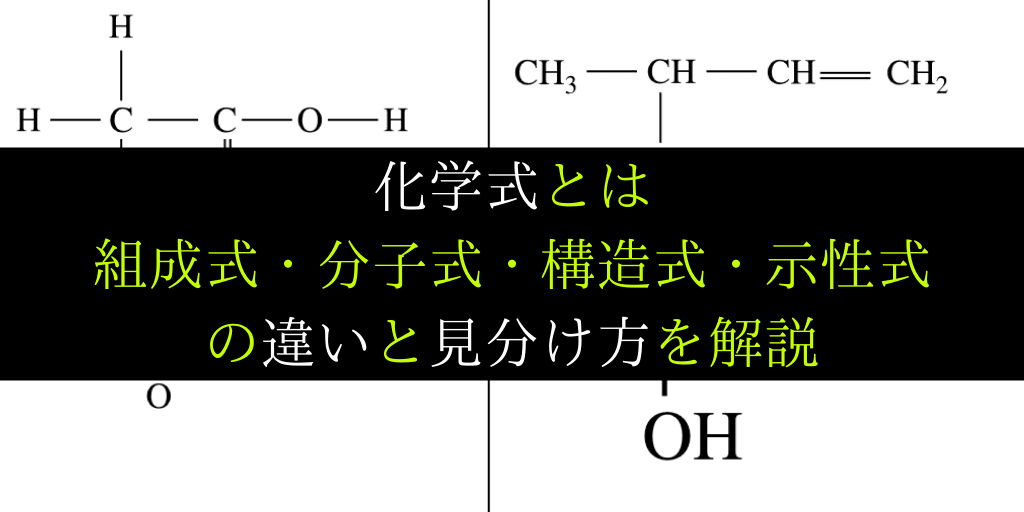



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説
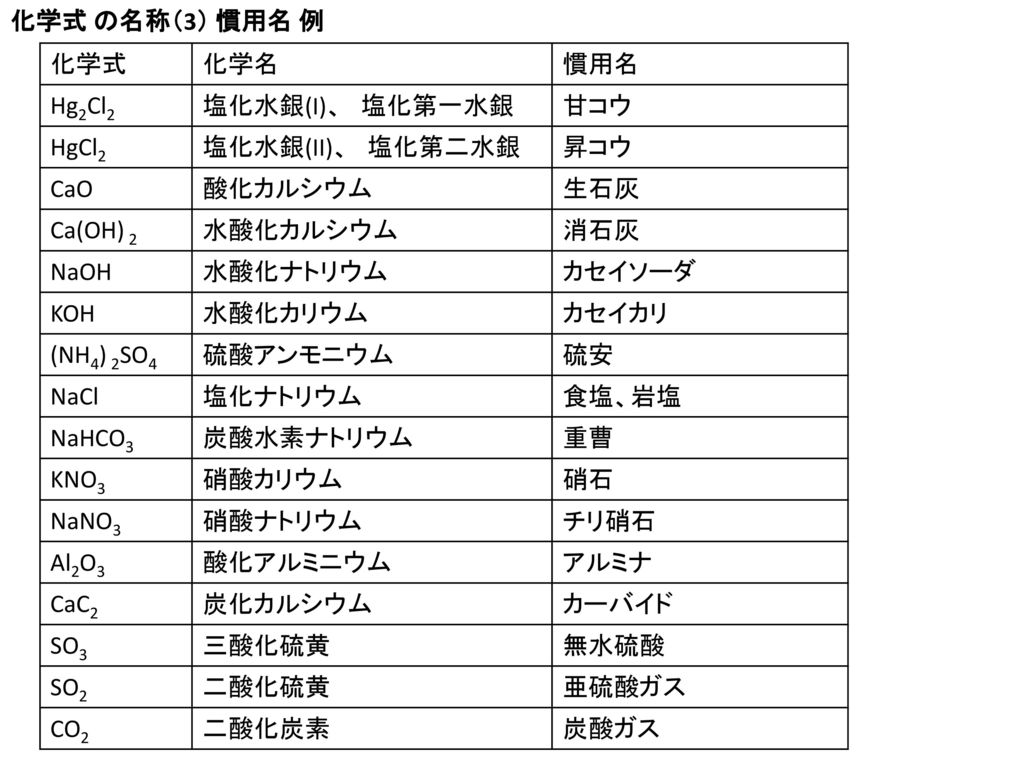



3章 イオン結合とイオン結晶 最終回 3 2 イオン結晶の構造 Ppt Download




1 2 1 イオン結晶と組成式 化学基礎 Youtube




化学 板書 No Twitter 化学基礎 イオン結合とイオン結晶




イオン結晶 共有結合の結晶 分子結晶まとめ 理系ラボ
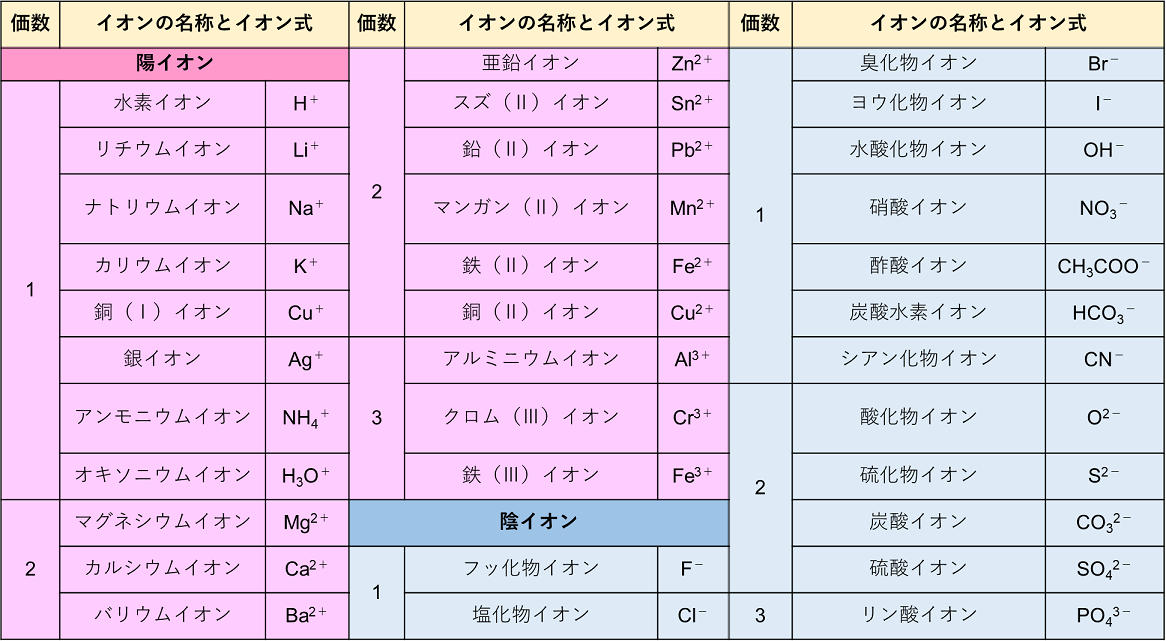



イオン結合と結晶




X D Times Descubre Como Resolverlo En Qanda




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




化学基礎 イオン結合の組成式 その2 作り方 Youtube




17 1 K Ci 2 A3 K02 L Lihat Cara Penyelesaian Di Qanda
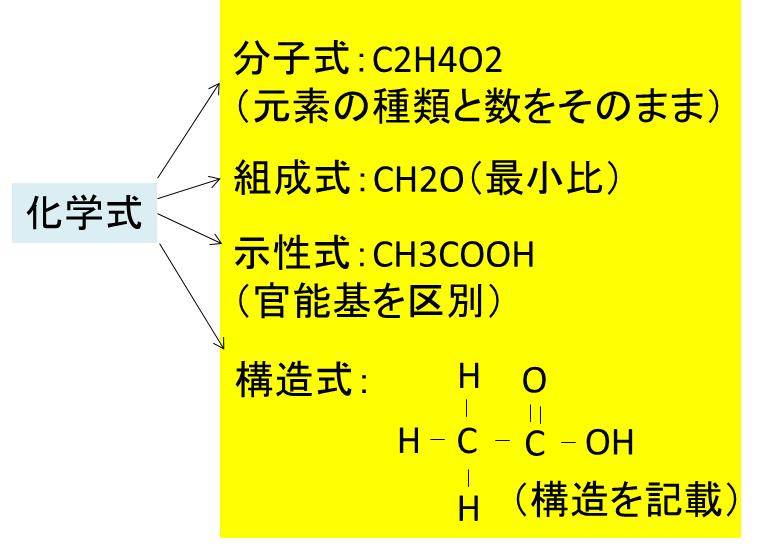



分子式 組成式 化学式 見分け方と違いは 演習問題




分子式 一覧 化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた
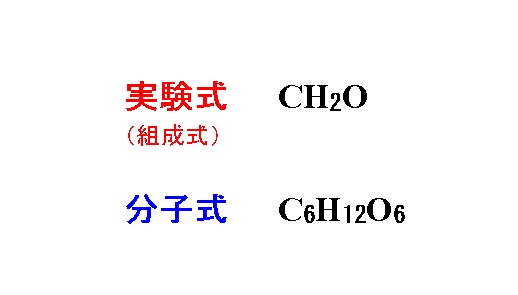



有機化合物の実験式 組成式 を求める計算と分子式の決定




Square Descubre Como Resolverlo En Qanda
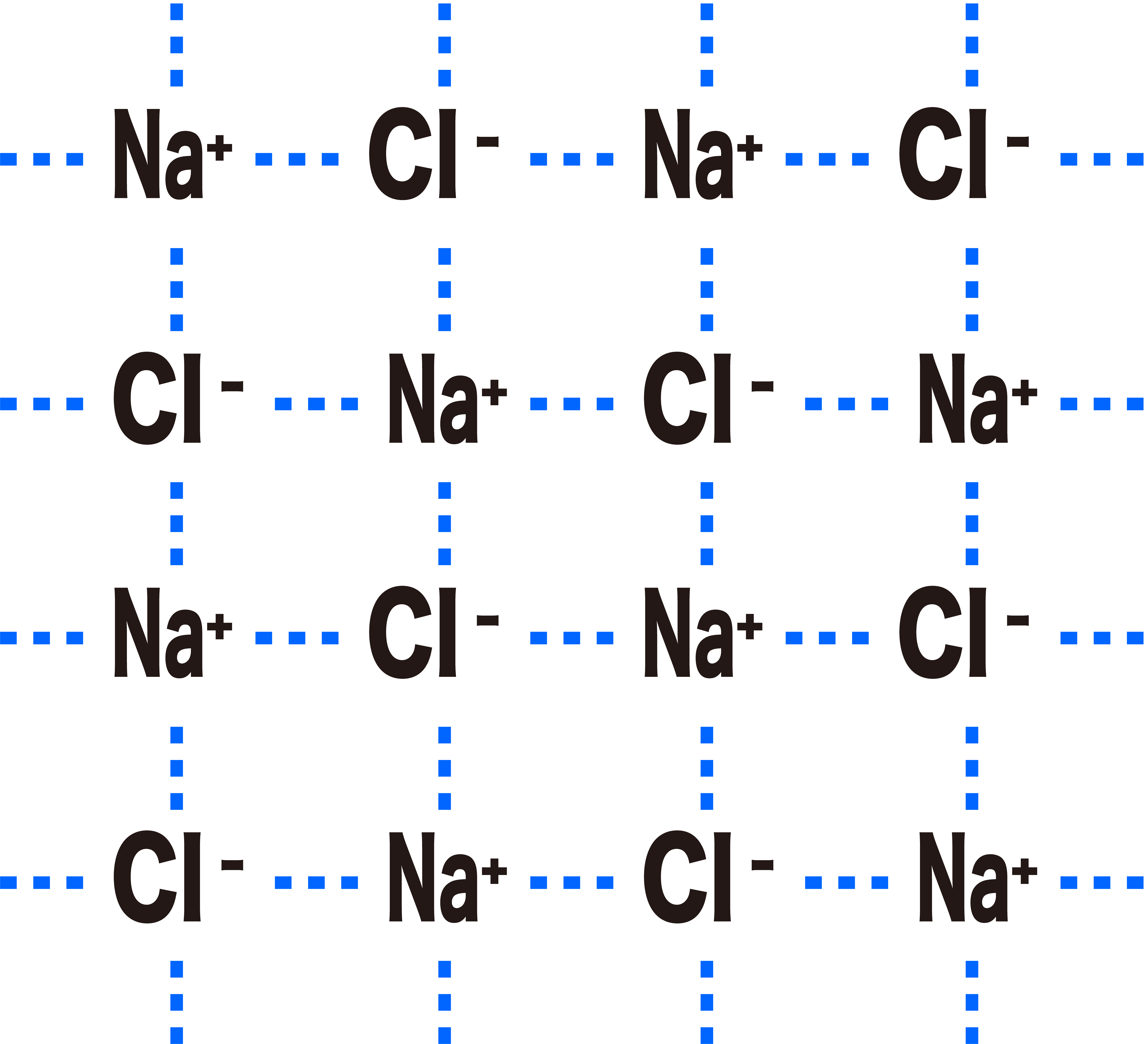



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ
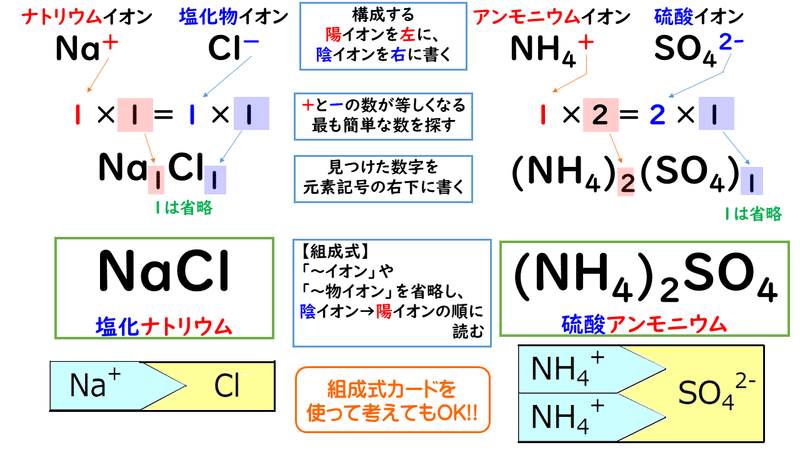



3 1 イオン結合とイオン結晶 おのれー Note




組成式と分子式の違いは なぜsio2が組成式なのか 化学受験テクニック塾




イオン結合とイオン結晶




2cl Kubo Pdf Chem5 Pdfca2 2cl Cacl 2 陽イオン 価数数 陰イオン 価数数 P25 2 イオン結晶の組成式の考え方 Nh4 Nh 4 多原子イオンの場合 Co3 2 Nh
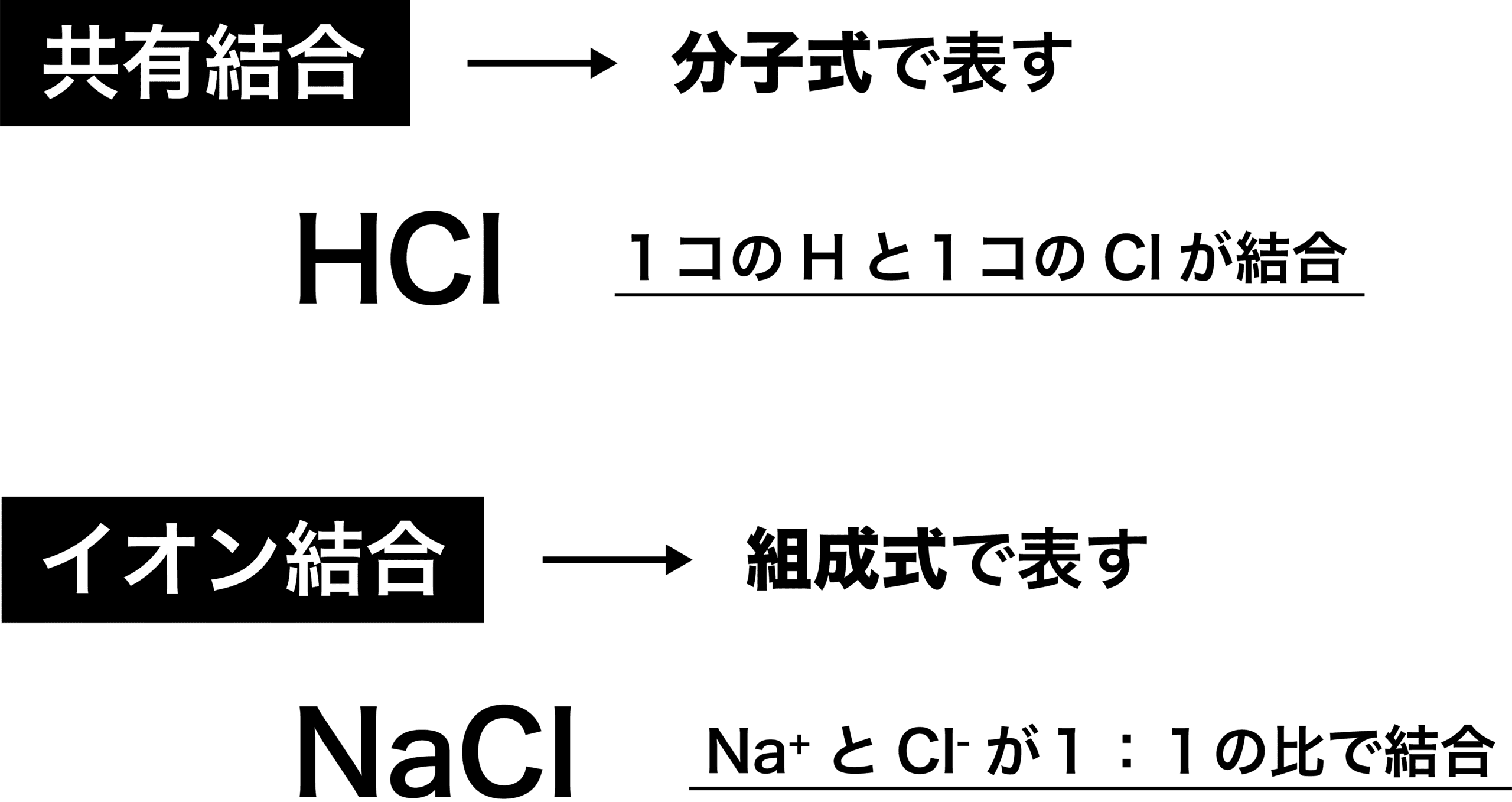



イオン結合 例 共有結合との違い 特徴 強さなど 化学のグルメ
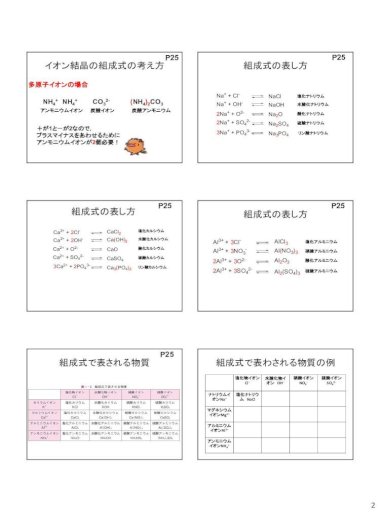



2cl Kubo Pdf Chem5 Pdfca2 2cl Cacl 2 陽イオン 価数数 陰イオン 価数数 P25 2 イオン結晶の組成式の考え方 Nh4 Nh 4 多原子イオンの場合 Co3 2 Nh




イオン結晶とは イオン結晶のポイントを分かりやすく解説 高校生向け受験応援メディア 受験のミカタ




Descubre Como Resolverlo En Qanda



1 1 Descubre Como Resolverlo En Qanda




W O 暗記フェス O覚えて便利 イオン式まとめ 高校生 化学のノート Clear




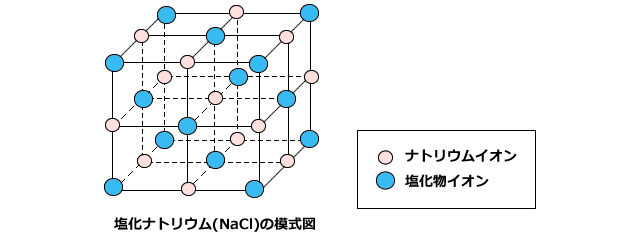
塩化ナトリウム Nacl の化学式 分子式 構造式 電子式 イオン式 分子量は 塩化ナトリウムと硝酸銀の反応式



トップ 100 マグネシウム 化学式 すべての鉱山クラフトのアイデア




教えてください 課題ですけど全くわかりません Clear



イオン結合でできるイオン結晶を表す組成式って何




化学基礎 イオン結合の組成式 その3 よく間違えるところ Youtube




テ対 イオン結合と組成式 イオン結晶 分子と共有結合 高校生 化学のノート Clear




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




硝酸 アルミニウム 組成 式 硝酸アルミニウムとアンモニア水との反応




イオン結晶とは イオン結晶のポイントを分かりやすく解説 高校生向け受験応援メディア 受験のミカタ


